-

-
北京協(xié)和醫(yī)院
-
三級甲等
北京協(xié)和醫(yī)院是集醫(yī)療、教學、科研于一體的現(xiàn)代化綜合三級甲等醫(yī)院,是國家衛(wèi)生健康委指定的全國疑難重癥診治指導中心,最早承擔高干保健和外賓醫(yī)療任務的醫(yī)院之一,也是高等醫(yī)學教育和住院醫(yī)師規(guī)范化培訓國家 級
-
-

-
四川大學華西醫(yī)院
-
三級甲等
錦江春色來天地,玉壘浮云變古今。在中國歷史文化名城成都市錦江萬里橋頭的華西壩,有一座聞名遐邇的醫(yī)學城,她就是四川大學華西臨床醫(yī)學院/華西醫(yī)院。追溯歷史,華西醫(yī)院起源于美國、加拿大、英國等國基督教會1
-
-

-
中國人民解放軍總醫(yī)院
-
三級甲等
? ?一、歷史沿革中國人民解放軍總醫(yī)院前身是中國協(xié)和醫(yī)學院第二臨床學院,1953年10月,總后方勤務部衛(wèi)生部決定將“中國協(xié)和醫(yī)學院第二臨床學院”改為“軍委直屬機關醫(yī)院”。1954年7月,總后方勤務部
-
-

-
復旦大學附屬中山醫(yī)院
-
三級甲等
復旦大學附屬中山醫(yī)院是國家衛(wèi)生健康委員會委屬事業(yè)單位,是復旦大學附屬綜合性教學醫(yī)院。醫(yī)院開業(yè)于1937年,是中國人創(chuàng)建和管理的最早的大型綜合性醫(yī)院之一,隸屬于國立上海醫(yī)學院,為紀念中國民主革命的先驅孫
-
朗沐(康柏西普眼用注射液)
通用名稱:朗沐(康柏西普眼用注射液)
批準文號:國藥準字S20130012
生產企業(yè): 成都康弘生物科技有限公司
功能主治:本品適用于治療:
溫馨提示:外觀包裝僅供參考;請按藥品說明書或者在藥師指導下購買和使用。
| 藥品信息 | |||
| 主要成分 |
本品主要成分為康柏西普。 |
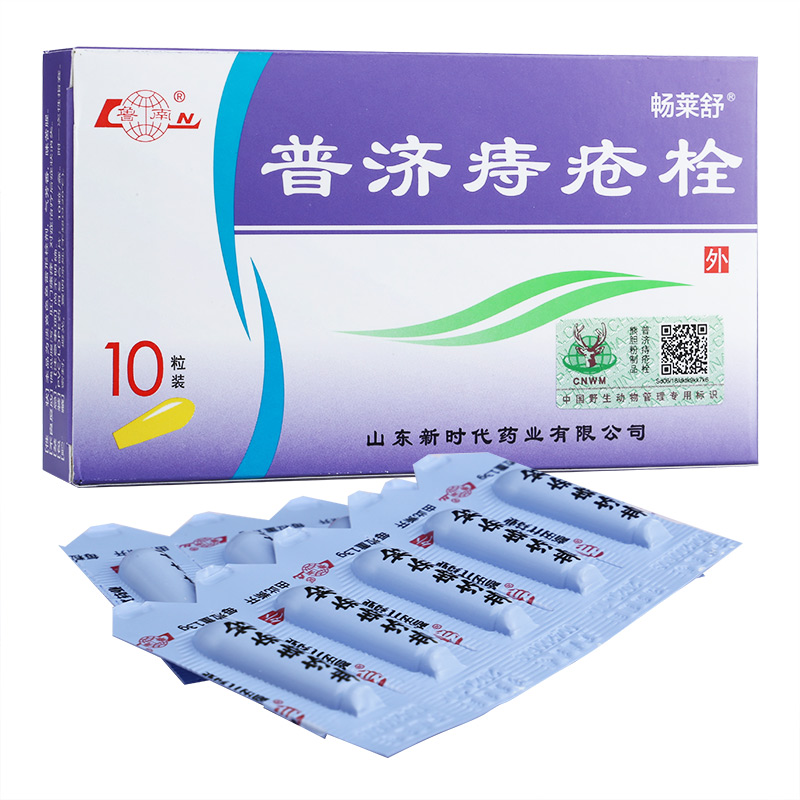
熊膽粉、冰片、豬膽粉。 |
|
| 生產企業(yè) |
成都康弘生物科技有限公司 |
山東新時代藥業(yè)有限公司 |
|
| 批準文號 |
國藥準字S20130012 |
國藥準字Z20030093 |
|
| 說明 | |||
| 作用與功效 |
本品適用于治療: |
清熱解毒,涼血止血,用于熱證便血。對各期內痔、便血及混合痔腫脹等有較好的療效。 |
|
| 用法用量 |
本品應在有資質的醫(yī)院和眼科醫(yī)師中使用。醫(yī)院應具備該疾病診斷和治療所需的相關儀器設備和條件,由具備確診新生血管性(濕性)年齡相關性黃斑變性(nAMD)和繼發(fā)于病理性近視的脈絡膜新生血管(mCNV)引起的視力損傷的能力和豐富的玻璃體腔內注射經(jīng)驗的眼科醫(yī)生進行診斷和治療操作。 1、一般給藥信息:本品僅用于經(jīng)玻璃體腔內注射給藥。 2、新生血管性(濕性)年齡相關性黃斑變性(nAMD): 推薦給藥方案為:推薦劑量為每次0.5mg(相當于0.05ml的注射量),初始3個月,每個月玻璃體腔內給藥1次,之后每3個月玻璃體腔內給藥1次。或者,在初始3個月連續(xù)每月玻璃體腔內給藥1次,之后按需給藥。這種方案需要患者每月隨訪,由眼科醫(yī)師根據(jù)患者的視力和影像學結果,評估是否因活動性病變而需要再次給藥治療。初始連續(xù)給藥3次后,按需給藥與每3個月給藥1次相比,需要更多的隨訪和檢查,但患者可能在更合理的給藥次數(shù)情況下獲得更佳的治療效果。治療期間應關注患者視力變化情況,如果出現(xiàn)顯著的視力下降,患者應根據(jù)眼科醫(yī)師的評估進一步接受本品注射治療。兩次注射之間的間隔時間不得小于1個月。 3、繼發(fā)于病理性近視的脈絡膜新生血管(mCNV)引起的視力損傷: 推薦的給藥方案為:推薦劑量為每次0.5mg(相當于0.05ml的注射量),初始3個月,連續(xù)每月玻璃體腔內給藥1次,之后按需給藥。按需給藥方案需要患者每月隨訪,由眼科醫(yī)師根據(jù)患者的視力和影像學結果,評估是否因活動性病變而需要再次給藥治療。治療期間應關注患者視力變化情況,兩次注射之間的間隔時間不得小于1個月。 (1)給藥方法: ①術前準備:在玻璃體腔內注射給藥前,應對患者的既往病史進行全面的評估,以評估其發(fā)生高敏反應的可能性。本品必須在無菌條件下進行玻璃體腔內注射,其中包括采用外科手術的手部消毒、無菌口罩、無菌手套、無菌手術單和無菌開瞼器(或類似器具)。注射前必須給予患者適當?shù)穆樽韯┖脱劬植坑脧V譜抗生素。注射前消毒眼周皮膚、眼瞼和眼球表面。 ②藥品準備:本品為一次性無菌中性硼硅玻璃管制注射劑瓶(西林瓶)包裝。應在給藥前進行康柏西普眼用注射液外觀檢查,如發(fā)現(xiàn)藥物有微粒、渾濁、變色,則不能使用。玻璃體腔內注射操作應采用30G一次性無菌注射針頭。請嚴格按照使用說明進行本品配置操作。 ③注射操作:囑患者朝遠離注射部位的方向注視;距角鞏膜緣3.5-4.0mm的范圍進針,應傾斜緩慢刺入鞏膜,針尖朝向眼球中心(避免傷及晶狀體)。小心緩慢推完藥液。拔出針頭,使用棉簽壓迫穿刺孔防止藥液反流。 每支康柏西普眼用注射液只能用于一只眼的單次治療。盡量避免同一患者雙眼同時治療,如果必須進行,應當重新消毒,更換藥物和注射器具。 (4)注射后: 注射結束時結膜囊內可滴入抗生素。注射后一周內應對患者進行監(jiān)測;叮囑患者出現(xiàn)眼部疼痛或不適、眼紅加重、畏光或視力下降等癥狀時,及時向醫(yī)師報告。 4、特殊人群用藥: (1)腎損害:尚無相關研究。由于全身暴露可忽略不計,無須采取特別措施。 (2)肝損害:尚無相關研究。由于全身暴露可忽略不計,無須采取特別措施。 (3)兒童與青少年(18歲以下):尚無相關的安全與有效性數(shù)據(jù)。 (4)老年患者:無需調整劑量。 |
直腸給藥。一次1粒,一日2次,或遵醫(yī)囑。 |
|
| 副作用 |
1、對于康柏西普或藥品成分中任何一種輔料過敏的患者禁用。過敏反應可引發(fā)嚴重的眼內炎癥反應。 2、眼部或眼周感染的患者禁用。 3、活動性眼內炎癥患者禁用。 |
偶見腹瀉,肛門瘙癢,對癥治療后癥狀消失。 |
|
| 禁忌 |
|
|
|
| 成分 |
本品適用于治療: |
清熱解毒,涼血止血,用于熱證便血。對各期內痔、便血及混合痔腫脹等有較好的療效。 |
|
| 藥理作用 |
1、臨床試驗數(shù)據(jù) (1)新生血管性(濕性)年齡相關性黃斑變性(nAMD): 在4項以新生血管性(濕性)年齡相關性黃斑變性(nAMD)患者為研究人群的臨床試驗(HOPE、BRIDGE、AURORA和PHOENIX)中,共292例患者接受康柏西普眼用注射液治療,試驗中最常見的不良反應為:注射部位出血、眼內壓增高和結膜充血,這3種不良反應均由玻璃體腔內注射引起,且程度較輕,大多數(shù)無需治療即可恢復。其他的不良反應包括結膜炎、視覺靈敏度減退、玻璃體飛蛾癥、白內障、視網(wǎng)膜出血、玻璃體混濁、術后炎癥、角膜上皮缺損等,極少數(shù)患者出現(xiàn)視物變形癥、眼炎癥、干眼癥、過敏性結膜炎、黃斑水腫、注射部位損傷、虹膜睫狀體炎、虹膜炎、葡萄膜炎、視網(wǎng)膜破裂、眼充血、眼內炎、眼痛等偶發(fā)的不良反應。 (2)繼發(fā)于病理性近視的脈絡膜新生血管(mCNV)引起的視力損傷 在一項以繼發(fā)于病理性近視的脈絡膜新生血管(mCNV)引起的視力損傷為研究人群的III期臨床試驗中,共171例患者接受康柏西普眼用注射液治療。治療組在整個試驗期間最常見的不良反應為注射部位出血和眼內壓增高,這2種不良反應程度都為輕度,且均由玻璃體腔內注射引起,大多數(shù)患者無需治療即可恢復。其他的不良反應包括眼內炎、非傳染性(非感染性)眼內炎、眼痛、角膜沉積物、眼壓降低、眼炎癥等,極少數(shù)患者出現(xiàn)注射部位水腫、視網(wǎng)膜出血、玻璃體出血、玻璃體飛蛾癥、玻璃體疾病、結膜炎、前房炎癥、視覺靈敏度減退等偶發(fā)的不良反應。 2、上市后監(jiān)測數(shù)據(jù): 根據(jù)一項上市后5千多例的回顧性安全性研究,和截止2015年11月26日臨床用藥的自發(fā)性安全報告,監(jiān)測到的多數(shù)不良反應與臨床試驗中觀察到的一致。此外,還有少量新發(fā)現(xiàn)的不良反應包括: (1)眼局部不良反應:視網(wǎng)膜脫離、玻璃體腔積血、角膜上皮脫離、前房混濁、視網(wǎng)膜出血、玻璃體腔內異物、眼異物感、眼瞼水腫、眼睛不適、結膜水腫和角膜水腫。 (2)全身不良反應:骨骼肌肉疼痛和帶狀皰疹、過敏(皮疹、蕁麻疹)、偏頭痛。以及新發(fā)現(xiàn)的不良事件:心前區(qū)不適1例,尚不能確定其與藥物的相關性。 3、相同作用機制產品相關安全性風險: 根據(jù)相同作用機制產品的公開報道和文獻,接受抗VEGF治療的安全性風險還包括: (1)常見的眼部不良反應:玻璃體脫離、視覺障礙、玻璃體漂浮物、結膜出血、眼部刺激、眼異物感、流淚增加、瞼緣炎、眼瘙癢、視網(wǎng)膜變性、視網(wǎng)膜異常、視網(wǎng)膜色素上皮脫離、視網(wǎng)膜色素上皮撕裂、視力下降、玻璃體異常、后囊膜混濁、點狀角膜炎、角膜上皮擦傷、前房閃輝、視力模糊、眼部出血、眼分泌物、閃光幻覺、畏光、眼瞼痛、核性白內障、后囊下白內障、皮質性白內障、角膜糜爛等。 (2)不常見的眼部不良反應:晶狀體混濁、失明、前房積膿、前房出血、角膜病、虹膜粘連、角膜皺褶、注射部位刺激、眼瞼刺激等。 (3)部分受試者出現(xiàn)了皮疹、蕁麻疹、瘙癢和紅斑等過敏反應。 4、免疫原性: 同所有治療性蛋白藥物一樣,接受康柏西普治療的患者中有潛在出現(xiàn)免疫反應的可能。免疫原性數(shù)據(jù)高度依賴于檢測方法的靈敏性和特異性。 在康柏西普眼用注射液的I-II期臨床研究中,采用光學表面等離子共振(SurfacePlasmonResonance,SPR)技術,共檢測63例受試者的450份給藥前后的血清樣品,未檢測出明確的、針對康柏西普的特異性抗體。在以上研究中,共有4例患者發(fā)現(xiàn)可疑的陽性信號,其中2例患者用藥后的血清抗-康柏西普抗體響應值低于用藥前;另外2例采用梯度濃度法對抗-康柏西普抗體進行再次測量,結果顯示沒有濃度相關性,可能均為非特異結合,但提示應關注患者接受康柏西普眼用注射液治療后的免疫反應。 |
||
| 注意事項 |
1、玻璃體腔內注射,包括本品注射,與眼內炎、眼內感染、孔源性視網(wǎng)膜脫離、視網(wǎng)膜撕裂和醫(yī)源性外傷性白內障有關(參見【不良反應】)。本品注射時必須采用合格的無菌注射技術。此外,注射后一周內應監(jiān)測患者的情況,以便早期發(fā)現(xiàn)感染并治療。眼科醫(yī)師應指導患者在出現(xiàn)任何提示有眼內炎的癥狀或任何上述提到的事件時,立即報告給醫(yī)師。 2、本品注射后60分鐘(根據(jù)本品臨床研究情況描述)內可觀察到眼內壓升高(參見【不良反應】)。因此須同時對眼內壓和視神經(jīng)乳頭的血流灌注進行監(jiān)測和適當治療。雖然在康柏西普的臨床試驗階段尚未觀測到動脈血栓栓塞事件,同類型藥物國外大規(guī)模臨床試驗結果也顯示,接受玻璃體腔內注射血管內皮生長因子(VEGF)抑制劑的治療組和假注射對照組,動脈血栓栓塞事件的發(fā)生率是相近的,但是使用血管內皮生長因子(VEGF)抑制劑后,存在潛在的動脈血栓栓塞風險。 3、有文獻報道顯示,長期高頻率的使用抗VEGF藥物,有少數(shù)患者有可能出現(xiàn)地圖樣萎縮,提示長期過度使用本品也有出現(xiàn)地圖樣萎縮的可能。因此主治醫(yī)師應謹慎評價對這些患者使用本品治療是否合適,以及治療益處是否超過了潛在的風險。 4、同所有治療性蛋白藥物一樣,接受康柏西普治療的患者中有潛在出現(xiàn)免疫反應的可能。 5、尚未開展雙眼同時使用本品治療的安全性和有效性研究。如果雙眼同時接受治療,可能會使全身暴露量升高,從而導致全身不良事件的風險升高。 6、本品不得與其他抗血管內皮生長因子(VEGF)藥物同時使用(全身或局部使用)。 7、出現(xiàn)下述情況,應暫停給藥,且不得在下次計劃給藥時間之前恢復給藥: (1)與上次的視力檢查相比,最佳矯正視力(BCVA)的下降≥30字母。 (2)眼內壓≥30mmHg。 (3)視網(wǎng)膜撕裂。 (4)涉及中心凹中央的視網(wǎng)膜下出血,或出血面積占病灶面積的50%或更多。 (5)在給藥前后的28天已接受或計劃接受眼內手術。 8、接受抗VEGF治療新生血管性(濕性)年齡相關性黃斑變性(nAMD)之后,視網(wǎng)膜色素上皮撕裂的風險因素包括大面積的和/或高度隆起的視網(wǎng)膜色素上皮脫離。在具有這些視網(wǎng)膜色素上皮撕裂風險因素的患者中開始本品治療時應謹慎。 9、孔源性視網(wǎng)膜脫離,3期/4期黃斑裂孔患者應中斷治療。 10、本品治療可引起短暫的視覺障礙,這可能影響駕駛或機械操作的能力(參見【不良反應】)。出現(xiàn)這些癥狀的患者在這些暫時性的視覺障礙副作用消退前不能駕駛或進行機械操作。 11、孕婦及哺乳期婦女用藥: (1)妊娠::目前尚無本品在妊娠婦女中使用的數(shù)據(jù)。尚不清楚妊娠婦女使用本品是否會對胎兒造成傷害,或者會影響生育能力。故本品不得用于妊娠婦女,除非預期利益超過其對于胎兒的潛在風險時才可考慮使用。 (2)有生育力的婦女:有生育能力的婦女應在治療期間采取有效的避孕措施。 (3)哺乳:不清楚本品是否分泌入人乳汁中。作為預防性措施,建議患者在本品治療期間不要哺乳。 12、兒童用藥:尚未進行該項研究,且無可靠參考文獻。 13、老年用藥: 在已開展的臨床試驗中,接受本品治療的患者平均年齡為66.27±8.26歲,約53.7%的患者年齡≥65歲,約19.7%的患者年齡≥75歲。在這些試驗中,隨著年齡增加,沒有發(fā)現(xiàn)本品的有效性或安全性出現(xiàn)顯著差異。 14、藥物過量:尚未進行該項研究,且無可靠參考文獻。如果出現(xiàn)藥物過量,應監(jiān)測眼內壓并治療(如果主治醫(yī)師認為有必要時)。 |
1.孕婦慎用;2.忌食辛辣刺激性食物;3.保持大便通暢;4.內痔出血過多或原因不明的便血應去醫(yī)院就診;5.嚴重肝、腎疾患及對本品過敏者禁用。 |
|
藥品查詢
最新資訊
更多熱門藥品
更多-

枸櫞酸西地那非片
西地那非適用于治療勃起功能障礙。
-

鹽酸非索非那定片
1.季節(jié)性過敏性鼻炎適用于緩解成人和6歲及6歲以上年齡兒童的季節(jié)性過敏性鼻炎相關的癥狀,如打噴嚏,流鼻涕,鼻、腭、喉部發(fā)癢、眼睛發(fā)癢、潮濕、發(fā)紅。 2.慢性特發(fā)性蕁麻疹適用于治療成人和6歲及6歲以上年齡兒童的慢性特發(fā)性蕁麻疹的皮膚癥狀,能夠顯著減輕瘙癢和風團的數(shù)量。
-

感冒靈膠囊
解熱鎮(zhèn)痛。用于感冒引起的頭痛,發(fā)熱,鼻塞,流涕,咽痛。
-

連花清瘟顆粒
清瘟解毒,宣肺泄熱。用于治療流行性感冒屬熱毒襲肺證,癥見:發(fā)熱或高熱惡寒,肌肉酸痛,鼻塞流涕,咳嗽,頭痛,咽干咽痛,舌偏紅,苔黃或黃膩。
-

參苓白術膠囊
健脾,益氣。用于體倦乏力,食少便溏。
-

遠紅外消炎止痛貼
適用于促進局部血液循環(huán)、輔助消炎、消腫和止痛。適用于對頸椎病、肩周炎、骨質增生、腰椎間盤突出、關節(jié)炎、肌纖維炎、軟組織扭挫傷、急性腰肌勞損的輔助治療。適用于緩解腿部關節(jié)、肌肉疼痛及肱骨外上髁炎引起的關節(jié)滑膜炎所致之疼痛。
-

加味藿香正氣丸
解表化濕,理氣和中。本品用于外感風寒,內傷濕滯,頭痛昏重,胸膈痞悶,脘腹脹痛,嘔吐泄瀉。
-

依折麥布片
1.原發(fā)性高膽固醇血癥本品作為飲食控制以外的輔助治療,可單獨或與HMG-CoA還原酶抑制(他汀類)聯(lián)合應用于治療原發(fā)性(雜合子家族性或非家族性)高膽固醇血癥,可降低總膽固醇(TC)、低密度脂蛋白膽固醇(LDL-C)、載脂蛋白B(ApoB)。 2.純合子家族性高膽固醇血癥(HoFH)本品與他汀類聯(lián)合應用,可作為其他降脂治療的輔助療法(如LDL-C血漿分離置換法),或在其他降脂治療無效時用于降低HoFH患者的TC和LDL-C水平。 3.純合子谷甾醇血癥(或植物甾醇血癥)本品作為飲食控制以外的輔助治療,用于降低純合子家族性谷甾醇血癥患者的谷甾醇和植物甾醇水平。
-

氯雷他定顆粒
用于治療季節(jié)性過敏性鼻炎(減輕鼻部或非鼻部癥狀)及特發(fā)性蕁麻疹。
-

咳特靈膠囊
鎮(zhèn)咳,祛痰,平喘,消炎。用于咳喘及慢性支氣管炎咳嗽。
藥企推薦
更多-

廣東羅浮山國藥股份有限公司
廣東羅浮山國藥股份有限公司是一家從事藥品生產,藥品經(jīng)營,中草藥收購等業(yè)務的公司,成立于2008年12月24日,公司坐落在廣東省,詳細地址為:惠州市博羅縣長寧鎮(zhèn)廣汕公路邊嶺排工業(yè)區(qū)(羅浮山藥業(yè)城);經(jīng)國
-

北京韓美藥品有限公司
北京韓美藥品有限公司(以下簡稱北京韓美)成立于1996年3月,公司產品業(yè)務涉及兒科產品、消化科產品、骨科產品、抗感染藥等領域,98%的產品在國內成產,主要產品有媽咪愛、易坦靜、易安平、美常安、利動、
-

博福-益普生(天津)制藥有限公司
益普生集團作為一家有著八十多年制藥經(jīng)驗的歐洲制藥集團,擁有20余種上市產品及遍布全球近4000名的員工。公司的發(fā)展戰(zhàn)略是以三大治療領域內的高科技產品為基礎,即腫瘤、內分泌、神經(jīng)肌肉類疾病,這些高
-

北京同仁堂股份有限公司同仁堂制藥廠
北京同仁堂股份有限公司同仁堂制藥廠成立于1990年11月21日,注冊地位于北京市大興區(qū)中關村科技園區(qū)大興生物醫(yī)藥產業(yè)基地天貴大街33號,法定代表人為張朝華。經(jīng)營范圍包括加工、制造中成藥;出租辦公用房
-

輝瑞制藥有限公司
輝瑞在中國業(yè)務覆蓋全國300余個城市,并在華上市了五大領域的高品質的創(chuàng)新藥物,包括腫瘤、疫苗、抗感染、炎癥與免疫、罕見病等多個領域的處方藥和疫苗。多年來,輝瑞始終致力于“成為中國醫(yī)療衛(wèi)生體系重要組成
-

石家莊以嶺藥業(yè)股份有限公司
石家莊以嶺藥業(yè)股份有限公司于1992年6月16日創(chuàng)建,公司以“繼承創(chuàng)新、造福人類”為企業(yè)宗旨,以“科技健康明天”為企業(yè)發(fā)展目標,以健康人類為己任,造福社會為弘愿,始終堅持市場龍頭、科技驅動的創(chuàng)新發(fā)展
-

北京同仁堂科技發(fā)展股份有限公司制藥廠
北京同仁堂科技發(fā)展股份有限公司制藥廠成立于1980年07月31日,注冊地位于北京市豐臺區(qū)南三環(huán)中路20號,法定代表人為王煜煒。經(jīng)營范圍包括制造膠劑、口服液、丸劑、顆粒劑、糖漿劑、擦劑、氣霧劑、軟膠囊
-

海南碧凱藥業(yè)有限公司
海南碧凱藥業(yè)有限公司成立于1993年。是【國家高新技術企業(yè)】、國家工商總局【守合同重信譽單位】、海口工業(yè)【十佳企業(yè)】。擁有各類人才,員工近2000人。生產基地位于海口藥谷,占地134畝,建筑面積10